
Chers Lecteurs, Chers Amis,
Le Groupe d’Étude pour le Don d’Ovocytes est très heureux de vous présenter cette newsletter FFER. Elle est certes centrée sur l’exercice du don d’ovocytes en France mais aussi sur des aspects plus vastes dans le domaine de la fertilité notamment grâce à des travaux menés par les membres du GEDO.
Depuis 1999, notre association a pour objectif de promouvoir et développer le don d’ovocytes et l’accueil d’embryons, dans tous leurs aspects, de soutenir les professionnels investis dans ces thématiques, de contribuer à la visibilité du don d’ovocytes en France, en étant force de proposition pour en améliorer l’accès et l’efficience.
Elle travaille également dans le champ élargi de l’infertilité tant sur le plan fondamental que clinico-biologique, psychologique, juridique et sociétal. En effet, grâce à la diversité des membres de notre société, spécialistes en médecine et biologie de la reproduction, anthropologues, sociologues, juristes, psychologues, nous continuons nos travaux, au service de l’amélioration de la pratique du don d’ovocytes, mais aussi en explorant les thématiques émergentes, telles que la ROPA, la gestation pour autrui, ou plus récemment l’impact des réseaux sociaux sur le don d’ovocytes, le phénomène « child free » et la gamétogénèse in vitro.
Pour illustrer nos travaux, vous trouverez ici le résumé de notre Journée du GEDO d’Octobre 2025, ainsi que les résumés de certaines des communications présentées.



1. La gamétogenèse in vitro (GIV)
La possibilité de recréer des gamètes à partir de cellules différenciées de l’organisme a été présentée par le Dr Gabriel Livera, le Dr Hélène Letur et Mme Anne Le Goff. Si cette technique a été réalisée avec succès chez la souris, avec un taux d’efficacité cependant faible, elle n’a pas encore abouti à ce jour chez l’humain. Les recherches néanmoins se poursuivent notamment dans le domaine du développement gonadique, niche incontournable pour le développement abouti de cette gamétogénèse. La perception du public français à cette technique apparaît assez favorable avec cependant de nombreuses craintes exprimées concernant surtout la qualité des gamètes et les modalités d’utilisation. En effet, de nombreuses questions éthiques sont soulevées, notamment relatives à la sécurité des gamètes obtenus, aux indications d’utilisation et à l’équité d’accès ainsi qu’au coût de la technique. Celle-ci pourrait devenir un outil nouveau pour la procréation mais aussi être un apport pour la compréhension des mécanismes et pathologies de la gamétogénèse.
Résumé de l’intervention d’Anne Le Goff à la journée du GEDO (octobre 2025)
Anne Le Goff est enseignante-chercheuse à SupBiotech, Paris
Anne Le Goff a présenté ses travaux sur les aspects éthiques et sociaux de la gamétogénèse in vitro (GIV). La GIV est un domaine émergent des recherches sur les cellules souches qui vise à produire in vitro des cellules germinales à partir de cellules souches. Aujourd’hui, ces recherches ont montré que des ovules et des spermatozoïdes de souris pouvaient être produits in vitro, tandis que les recherches se poursuivent avec des cellules humaines, suscitant de nombreux attentes et espoirs pour la recherche et la médecine de la reproduction.
Quelles sont les questions éthiques que soulèvent ces recherches et leurs possibles usages ? Une biotechnologie émergente telle que la GIV pose la difficulté que la réflexion qu’on mène dessus aujourd’hui sont nécessairement par anticipation. Il est pourtant essentiel que d’en débattre au sein de la société en amont plutôt qu’a posteriori. Tout l’enjeu est donc de d’éclairer ces recherches sans simplement figer les projections qu’en font différents groupes d’acteurs impliqués – scientifiques, médecins, entreprises, patients, grand public… En effet, c’est du débat social entre ces différents acteurs que pourra émerger une biotechnologie juste et socialement pertinente. Pour mener une telle analyse et identifier les points éthiques saillants, on peut s’appuyer sur des enquêtes empiriques auprès de divers acteurs et examiner des usages possibles à la fois à court et à long terme.
A long ou moyen terme, la GIV pourrait devenirune technologie de procréation médicalement assistée (PMA), en fournissant à une personne des gamètes lui permettant de faire une FIV, là où les gamètes sont absents ou non fonctionnels, ou bien où manquent des gamètes de l’autre sexe. Comme le soulignent des personnes interrogées et elles-mêmes en parcours de PMA, la question cruciale est de savoir à quelles conditions une telle technique pourrait être déployée de manière juste, à la fois en termes de sécurité pour l’enfant à venir et la personne enceinte mais aussi d’accès équitable sur le plan financier et légal. Envisager le GIV comme potentielle technique de PMA nous invite aussi à mettre en lumière les limites des technologies existantes, que ce soit le don de gamètes souvent non disponible ou la ponction ovocytaire, technique très invasive pour les femmes. Dans cet horizon d’application à la reproduction humaine, la GIV viendrait aussi s’ajouter à la transformation des représentations et pratiques sociales de la parentalité et du genre. Si ces applications de la GIV à la reproduction humaine cristallisent beaucoup des appréhensions de la GIV, elles restent cependant incertaines et laissent dans l’ombre d’autres enjeux de la GIV à plus court terme.
Ces enjeux touchent d’abord à l’éthique de la recherche. En effet, les recherches sur la lignée germinale portent des enjeux particuliers quant à l’embryon et à la transmission de modifications ou de décisions sélectives aux générations futures. Elles impliquent donc une transparence et une responsabilité toutes particulières dans la conduite de la science. La nécessité d’un débat social et d’un encadrement clair sont particulièrement forts, alors même que le potentiel médical et financier engendre le risque d’une course aux résultats entre équipes de recherche (publiques ou privées).
Enfin, ces recherches, de par les connaissances fondamentales qu’elles produisent mais aussi parce qu’elles peuvent permettre de modéliser in vitro des pathologies individuelles recèlent, à court terme, de fortes possibilités pour la connaissance de la reproduction et la médecine reproductive. Les enjeux éthiques prennent alors une autre forme : ce modèle pourrait amener à une meilleure prise en charge des pathologies d’infertilité.
2. Evidences et Incertitudes
2.1. Les endomètres fins par le Dr Paul Pirtea
Sous réserve d’une vérification de la cavité utérine au préalable, l’endomètre fin ne doit pas être considéré comme péjoratif. Les résultats de l’AMP sont conservés si le pattern hypoéchogène est présent (aspect en triple feuillet).
Épaisseur Endométriale : Est‑ce vraiment ce qui compte ? – Synthèse Clinique Détaillée – Pirtea 2025
Introduction
Historiquement, un seuil de 7 mm était considéré comme minimum pour un transfert embryonnaire. Cependant, des grossesses ont été obtenues même avec une épaisseur de 4–6 mm, remettant en cause ce seuil classique. L’importance réelle de l’épaisseur doit être replacée dans un contexte global.
Message clé : L’épaisseur endométriale seule ne suffit pas pour prédire le succès d’un transfert (implantation).
Limites et variabilité de l’épaisseur:
• Il s’agit d’une mesure hétérogène selon le cycle, l’opérateur et l’échographe.
• La valeur prédictive de l’épaisseur endométriale est faible pour les taux de naissance vivante (AUC≈0.5).
• L’Annulation des transferts en cas d’endomètre fin est un biais majeur dans les études rétrospectives.
• l’Aspect en triple feuillet (trilaminaire) et la qualité embryonnaire sont souvent plus pertinents que l’épaisseur endométriale seule.
Comparatif des Études Clés
Les études clés sont les suivantes:
| Étude | Population | Résultat Principal | Conclusion |
| Ata et al. 2023 | 969 TEC de blastocystes euploïdes | Pas de seuil; LBR 46.9% ≤6 mm | Annuler peut être injustifié |
| Gingold et al. 2025 | 261 266 cycles | LBR ↗ jusqu’à 12–15 mmmais très peu de transferts pour un endomètre < 7 mm | Attention aux biais |
| Genovese et al. 2025 | 30 676 TEC de blastocystes euploïdes | Pas de baisse nette en cycle naturel, en cas d’endomètre fin | Impact faible de l’épaisseur endométriale si l’embryon est euploïde |
Conduite Clinique Recommandée
• Vérifier la cavité en cas d’endomètre fin de manière répétée (hystéroscopie recommandée).
• Ne pas annuler systématiquement en cas d’embryon euploïde disponible.
• Considérer le pattern, vascularisation, contexte hormonal.
• Peu d’évidence pour les thérapies « épaississantes » (PRP, G‑CSF, Viagra…).
Privilégier une décision personnalisée plutôt qu’un seuil rigide.
Références
Pirtea (Synthèse), 2025
Sundström P. Human Reproduction, 1998
De Geyter C et al. Fertility and Sterility, 2000
Mathyk B et al. Reproductive Biomedicine Online, 2023
Ata B et al. Fertility & Sterility, 2023
Gingold JA et al. Fertility & Sterility, 2025
Genovese H et al. Human Reproduction, 2025
2.2. Une modélisation mathématique des programmes de don d’ovocytes par le Dr Thomas Rostain :
Elle permet une meilleure équité d’accès, un maintien du THB par receveuse tout en diminuant le nombre d’embryons cryoconservés.
Cette étude rétrospective multicentrique menée dans 12 centres français a inclus plus d’un millier de donneuses et a permis d’analyser de façon complète le devenir des embryons issus du don entre 2019 et 2022. Un constat fort émerge : une part importante des receveuses ne revient pas pour utiliser leurs embryons surnuméraires, entraînant la persistance d’embryons congelés plusieurs années après le don.
L’analyse statistique met en évidence une efficacité marginale décroissante : plus le nombre d’ovocytes attribués lors d’un même don augmente, plus le nombre d’embryons surnuméraires générés est important, sans bénéfice proportionnel en termes de grossesses ou de naissances. Autrement dit, augmenter l’attribution n’améliore pas les taux de naissance, mais accroît surtout la production d’embryons qui ne seront pas toujours utilisés.
Nous proposons donc de privilégier une attribution ovocytaire en deux temps, plutôt qu’un don unique majeur. Pour les ovocytes frais : un premier don de 4 ovocytes, avec possibilité d’un second don rapide si nécessaire. Pour les ovocytes vitrifiés : un schéma équivalent avec 5 ovocytes. Cette stratégie maintient les chances de naissance tout en limitant la constitution d’embryons congelés surnuméraires.
Il ne s’agit plus de « maximiser » dès le premier cycle, mais de construire un parcours progressif, équitable, adapté à l’âge et au projet de la patiente.
3. Conférence d’actualité : Les cellules buissonnières par Mme Lise Barnéoud :
Il s’agit ici de l’extraordinaire aventure des cellules buissonnières dans notre organisme, les échanges bidirectionnels de cellules entre la mère et son fœtus. Chacun de nous porte en soi des cellules de sa mère… et de ses ascendants, qui étaient conservées dans l’organisme de sa mère ! Ce microchimérisme est traité dans son ouvrage : « Les cellules buissonnières. L’enfant dont la mère n’était pas née et autres folles histoires du microchimérisme ». Ed Premier Parallèle.
Présentation du microchimérisme, par Lise Barnéoud
C’est un fait largement méconnu : nous portons toutes et tous des cellules d’autres individus en nous. Dans notre sang, notre cœur, nos poumons et même parfois dans nos gamètes se cachent des cellules humaines dotées d’un autre génome que le nôtre. Ce phénomène, qui concerne toutes les espèces placentaires, a été baptisé microchimérisme, en référence à la Chimère, cette créature monstrueuse de la mythologie grecque, assemblage de plusieurs espèces. Un terme sans doute malencontreux, car il nous transforme en (micro)monstres… Aux cellules microchimériques, je préfère donc employer le terme de cellules buissonnières1.
C’est dans les ventres maternels que nous nous construisons d’emblée par et avec les autres. Le placenta n’est pas cette barrière infranchissable que l’on imagine souvent : des cellules humaines peuvent le traverser et cela dans les deux sens, de l’organisme fœtal vers l’organisme maternel et vice-versa. Les femmes peuvent ainsi récupérer les cellules de tous les embryons qu’elles hébergent, qu’ils aient ou non donné lieu à une naissance. Et elles peuvent transmettre à leur fœtus non seulement leurs propres cellules mais aussi toutes les cellules buissonnières qu’elles portent : celles de leur mère comme celles issues de leurs éventuelles précédentes grossesses. Nous pouvons donc hériter des cellules de nos grand-mères maternelles ainsi que de nos aînés (vivants ou non). Toujours in utero, certains d’entre nous peuvent aussi échanger des cellules avec des jumeaux, y compris les « jumeaux fantômes », ces embryons qui disparaissent en cours de route. Enfin, après la naissance, nous pouvons encore récupérer des cellules d’autrui, en particulier durant l’allaitement ou encore lors d’une greffe (car les cellules du donneur sortent du greffon et s’établissent ailleurs, dans l’organisme du receveur).
Loin d’être inactives, ces cellules influencent notre biologie. Elles participent à réparer des plaies, régénérer nos tissus, éduquer notre système immunitaire. Mais elles peuvent aussi être à l’origine d’effets négatifs, comme des inflammations chroniques. Les chercheurs tentent désormais de comprendre ce qui peut faire basculer ces cellules du « côté obscur ».
Ce nouveau champ de recherche bouscule notre vision de nous-même, brouille nos liens de filiation. Les autres deviennent nôtres, le passé s’insinue dans le futur, le futur remonte dans le passé. La mort ne signe plus la disparition de nos cellules.
Telle est l’ampleur des chamboulements mis au jour par le microchimérisme.

4. Les aspects règlementaires dans le don d’ovocytes et l’insuffisance ovarienne
4.1. Le don secondaire par le Dr Claire de Vienne :
Le parcours et la prise en charge en France ainsi que la place des centres privés ont été exposés. Différentes mesures sont à mettre en œuvre pour favoriser le passage au don secondaire d’autant que trois quarts des femmes concernées par l’autoconservation ovocytaire se disent prêtes à faire don de leurs ovocytes cryoconservés en cas de non utilisation.
Don secondaire de gamètes et d’embryons – Résumé par Claire de Vienne

Encore une marge d’amélioration notable : 35% de l’activité d’accueil d’embryons est réalisée par 2 centres. Près de 60% des centres autorisés ont attribué des embryons à moins de 10 couples ou femmes. 19 centres sont actifs, dont 1 qui a débuté l’activité en 2024. 15 centres ont augmenté leur activité entre 2023 et 2024.
Figure : Nombre annuel de couples ou femmes ayant bénéficié d’au moins 1 transfert d’embryons.
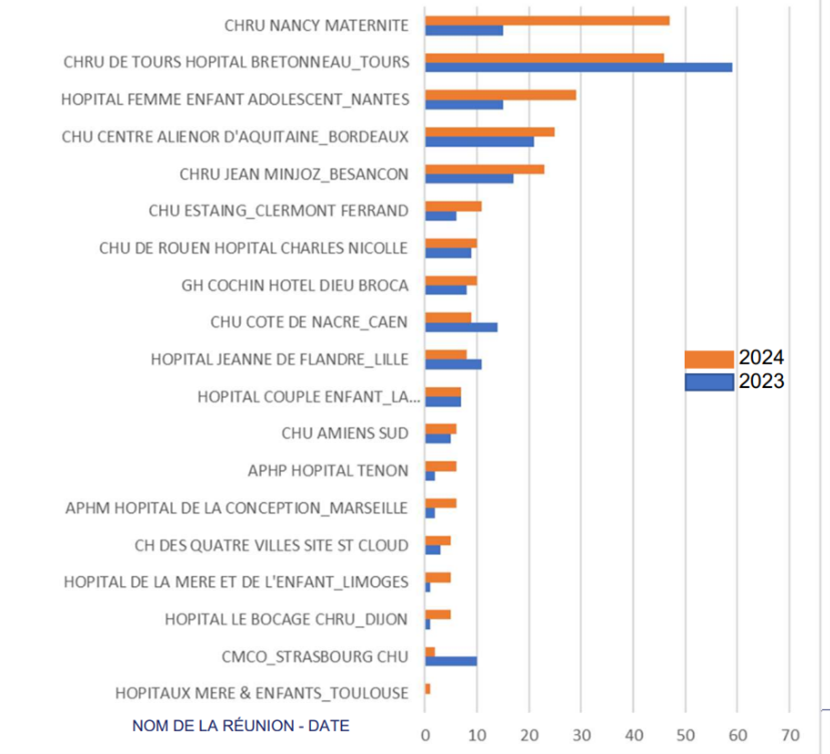
Le sondage Viavoice sur la conservation des ovocytes pour raison non médicale montre que les femmes sont favorables à 73% au don secondaire de leurs ovocytes.
Sur 1000 femmes interrogées, 35% sont sensibles au sujet de l’autoconservation pour elles-mêmes. 82% des femmes concernées par l’autoconservation ont été informées de la possibilité de donner les ovocytes non utilisés et ¾ seraient prêtes à effectivement en faire don.
Pour rappel, le e-learning de l’ABM sur l’encadrement juridique de l’AMP est accessible sur inscription (cf. le QRcode).

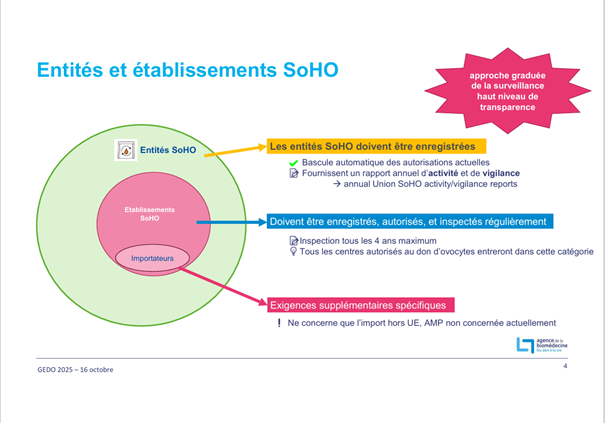
4.2. La règlementation européenne SoHO par le Dr Samuel Arrabal et le Dr Chloé Baron :
Elle sera applicable aux plateformes pluridisciplinaires de don d’ovocytes dès le 7 Août 2027. Il s’agit d’un règlement européen unique sur les standards de sécurité et qualité pour les substances d’origine humaine (SoHO) en remplacement des directives existantes. Outre le don d’ovocytes, ce règlement concerne toutes les substances d’origine humaine à utilisation thérapeutique à l’exception des organes.
Samuel Arrabal et Chloé Baron ont présenté les enjeux du nouveau règlement européen SoHO, qui entrera en application en 2027 et unifiera les règles de qualité, sécurité et traçabilité pour toutes les substances d’origine humaine, dont les gamètes et embryons.
Ils ont rappelé les principaux changements :
- enregistrement, autorisation et inspection des entités et établissements SoHO ;
- autorisation obligatoire des préparations SoHO, fondée sur une évaluation risques/bénéfices ;
- traçabilité renforcée (identifiant unique, archivage 30 ans, suivi des donneuses, alertes européennes) ;
- formalisation du transport des gamètes, désormais activité SoHO à part entière ;
- rôle structuré de la personne responsable SoHO.
Les intervenants ont souligné l’importance d’anticiper la transition : harmonisation, numérisation, adaptation des organisations et outils nationaux (dont un registre des donneuses) pour sécuriser l’évolution des pratiques en AMP.
4.3. Les nouvelles recommandations de l’ESHRE dans la prise en charge de l’insuffisance ovarienne prématurée par le Pr Micheline Misrahi-Abadou.
Le panel utilisé étudie 88 gènes dans le diagnostic de routine de l’IOP et rend compte de près de 30% des IOP jusqu’ici inexpliquées. Ce diagnostic, outre le bénéfice psychologique, permet une prise en charge personnalisée avec une information sur les comorbidités éventuelles, un pronostic de fertilité et une stratégie potentielle de prévention. Un screening familial est également proposé.

5. Le « non désir d’enfant »
5.1. Les demandes de stérilisations par le Dr Sylvie Bourdet-Loubère :
Le désir d’enfant est toujours ambivalent et la non ambivalence est toujours suspecte ! Alors que la maternité cesse d’être un destin pour devenir un choix, tous les désirs d’enfant n’aboutissent pas en projet parental. Quels sont les enjeux psychiques, cliniques et éthiques des demandes de stérilisation ? A travers des exemples cliniques, elle illustre que la stérilisation pourrait servir de coupure symbolique vis-à-vis d’une lignée féminine menaçante, que le refus de maternité peut servir de protection face à un risque d’effondrement psychique ou de défense contre une répétition traumatique.
Penser le non-désir d’enfant, par Sylvie Bourdet-Loubère
Le non-désir d’enfant occupe aujourd’hui une place nouvelle dans l’espace social. Podcasts, témoignages en ligne et ouvrages récents rendent visibles des positions longtemps tues ou stigmatisées. Cette émergence médiatique ne doit toutefois pas masquer la complexité psychique du phénomène : derrière un refus explicite se déploient des histoires singulières, des conflictualités latentes et des aménagements défensifs qu’il importe d’entendre dans leur épaisseur subjective.
Transformation des représentations de la maternité
Durant des siècles, la maternité fut pensée comme destin naturel et inévitable. Dans ce modèle normatif, le non-désir n’existait pas, il était invisibilisé ou pathologisé. Les lois sur la contraception (1967) et l’IVG (1975) ont ouvert la possibilité de dissocier sexualité, conjugalité et procréation. La maternité est devenue un choix, mais les normes sociales restent fortes. De nombreuses femmes doivent encore se justifier de ne pas vouloir d’enfant. Les données contemporaines confirment l’ampleur du phénomène : en France, environ 5% des femmes déclarent ne pas vouloir d’enfant, et jusqu’à 30% en Allemagne. Le non-désir devient pensable, mais demeure socialement discuté et doit être cliniquement questionné.
Désir / projet d’enfant : repères cliniques
Le désir d’enfant relève d’un registre inconscient, fait d’identifications, de fantasmes, d’enjeux narcissiques, d’idéalisations. Le projet parental s’inscrit quant à lui dans un système de décisions et de temporalités objectives et concrètes. Le non-désir n’est pas une simple absence de désir : il constitue une modalité de l’organisation psychique. En ce sens, il peut par exemple fonctionner comme défense mais il peut aussi concerner une position subjective élaborée, stable et non conflictuelle.
Figures cliniques et travail du négatif
A partir d’exemples cliniques issus de notre pratique, nous donnons à voir que le refus de maternité peut :
– Protéger d’un risque d’effondrement narcissique
– Tenir à distance un scénario traumatique enfoui (cryptes transgénérationnelles)
– Éviter la répétition d’un vécu maternel douloureux
– Préserver une autonomie psychique fragile
Dans ces situations, l’absence d’ambivalence ou la radicalité apparente ne doivent pas être prises au pied de la lettre mais entendues comme indices d’un fonctionnement psychique et d’une histoire subjective.
Enjeux éthiques et implications pour les pratiques
Les demandes croissantes de stérilisation volontaires exposent les équipes médicales à leurs propres représentations. Entre respect de l’autonomie et crainte du regret, un espace éthique doit être pensé. Pour certaines femmes, la stérilisation est un acte symbolique fort : rupture avec une filiation douloureuse, affirmation identitaire, refus d’une assignation normative. Le rôle du clinicien n’est ni d’autoriser ni d’interdire mais d’offrir un espace tiers pour donner du sens et permettre que la décision de la patiente puisse être authentiquement subjectivée et assumée.
Penser le non-désir d’enfant c’est finalement déplacer notre regard, ne pas chercher à comprendre « pourquoi elle ne veut pas d’enfant » mais ce « que signifie pour elle ce refus ». C’est accueillir le non-désir comme une position subjective et donc reconnaître la pluralité des trajectoires féminines et accompagner ces positions dans l’objectif que la patiente puisse se situer avec plus de liberté et de conscience de soi.
Pour aller plus loin :
Bourdet-Loubère, S. (à paraître janvier 2026). Le non-désir d’enfant. Enjeux éthiques et cliniques contemporains. Psychologie clinique.
5.2. La vasectomie avec refus de préservation de la fertilité par le Dr Charlotte Methorst :
La cryoconservation spermatique pré-vasectomie et les politiques européennes de préservation de la fertilité masculine avec analyse médico-économique comparative ont été décrites avec une évaluation des risques de détérioration spermatique et de regrets. Le taux de réutilisation des spermatozoïdes congelés post-vasectomie est de 3,4% en Europe sur les 15 dernières années. Médico-économiquement la cryoconservation systématique n’est pas justifiée. Une approche personnalisée basée sur l’évaluation du risque optimise le rapport coût-efficacité tout en respectant l’autonomie décisionnelle du patient. Pour les équipes, une formation continue est indispensable permettant l’intégration des outils d’aide à la décision.
5.3. Les conséquences des demandes de stérilisations par le Dr Daniel Rose :
Une comparaison des conséquences des vasectomies et des ligatures tubaires a été effectuée avec mise en lumière des différences de motivations, de suites cliniques et des raisons des potentiels risques de regrets. Les demandes de vasectomie marquent une augmentation exponentielle au regard d’une diminution importante des ligatures tubaires réalisées annuellement chez les femmes en âge de procréer.
Dans le cadre de notre soutien à différentes initiatives , nous avons, en tant que membres du Jury et relecteurs, activement participé au concours de nouvelles des Joyeuses Mères, une association très dynamique, à l’origine d’initiatives originales pour faire connaitre et reconnaitre la diversité des moyens de faire famille, dans une société en mouvement.

L’association | Les Joyeuses Mères
D’AMOUR ET DE PMA – Collectif Les Joyeuses Mères


Très bonne lecture !
Le Bureau du GEDO.



